Um ihr Wachstum zu beschleunigen, aktivieren Leukämiezellen in der Regel das Recycling zellulärer Strukturen, um sich von defekten Komponenten zu befreien und sich besser mit Baumaterial zu versorgen. Forscher der Goethe-Universität Frankfurt haben nun gezeigt, dass Leukämiezellen mit einer sehr häufigen Mutation spezifische Gene aktivieren, die für diesen Recycling-Prozess wichtig sind. Die Ergebnisse ihrer Studie, die im Journal Cell Reports veröffentlicht wurden, eröffnen neue therapeutische Möglichkeiten für die Zukunft.
In einer kürzlich durchgeführten Studie haben Wissenschaftler unter der Leitung von Professor Stefan Müller vom Institut für Biochemie II der Goethe-Universität eine spezifische Form von Blutkrebs untersucht, die als akute myeloische Leukämie oder AML bekannt ist. Die Krankheit tritt hauptsächlich im Erwachsenenalter auf und endet oft tödlich für ältere Patienten. Bei etwa einem Drittel der AML-Patienten hat das genetische Material der Krebszellen eine charakteristische Mutation, die das sogenannte NPM1-Gen betrifft, das die Bauanweisungen für ein Protein desselben Namens enthält.
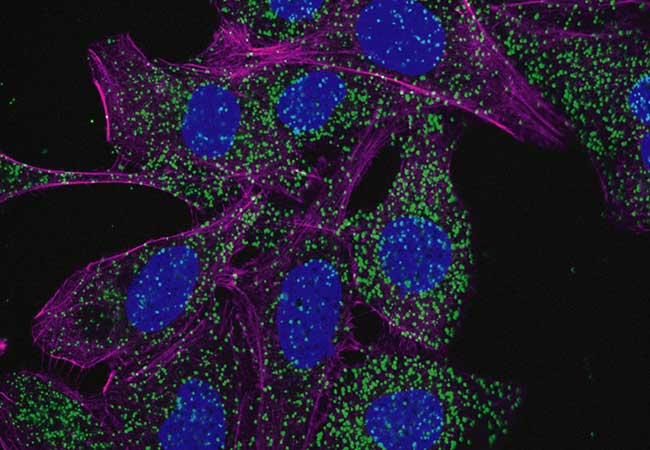
Während bekannt war, dass die mutierte NPM1-Variante (abgekürzt als NPM1c) ein wichtiger Faktor für die Entwicklung von Leukämie ist, haben Müller und sein Team nun einen neuen Weg entdeckt, wie die NPM1c-Genvariante dies bewirkt. Die veränderte Protein greift in die Autophagie ein, einen wichtigen Zellprozess, bei dem die Zelle ihre eigenen Strukturen recycelt. Diese “Selbstverdauung” dient einerseits dazu, defekte Moleküle zu entfernen, andererseits ermöglicht sie der Zelle, ihren Bedarf an wichtigen Bausteinen zu decken, auch bei Nährstoffmangel oder erhöhter Zellproliferation, die für Krebszellen charakteristisch ist.
Während der Autophagie produziert die Zelle zunächst eine Art Müllsack, den Autophagosom, in den sie die zu zerlegenden und bei Bedarf zu recycelnden zellulären Komponenten packt. Dieser Müllsack wird dann zum Recycling-Zentrum der Zelle, dem sogenannten Lysosom, transportiert, wo sein Inhalt mit Hilfe von Säure und Enzymen abgebaut wird. Von hier aus werden die Bausteine dann in die Zelle freigesetzt, wo sie wieder verwendet werden können. Müller und sein Team konnten zeigen, dass NPM1c die Produktion sowohl von Autophagosomen als auch von Lysosomen fördert.
Die Forscher haben auch herausgefunden, wie NPM1c diese Effekte vermittelt: Es bindet an einen zentralen Regulator des Autophagosom-Lysosom-Systems namens GABARAP und aktiviert ihn somit. Anhand von Computersimulationen haben sie gezeigt, dass diese Bindung von NPM1c und GABARAP eine atypische Struktur aufweist. Basierend auf diesen Erkenntnissen könnten nun Wirkstoffe entwickelt werden, die gezielt die Bindung von NPM1c an GABARAP beeinflussen und somit das Wachstum von Leukämiezellen bekämpfen können.